Si pudiéramos observar las moléculas por dentro con un potente lente, veríamos que los átomos que las conforman se ubican en el espacio en posiciones bien determinadas. El ordenamiento tridemensional de los átomos en una molécula se llama geometría molecular.
En una molécula con enlaces covalentes hay pares de electrones que participan en los enlaces oelectrones enlazantes, y electrones desapareados, que no intervienen en los enlaces o electrones no enlazantes. La interacción eléctrica que se da entre estos pares de electrones, determina la disposición de los átomos en la molécula. Veamos algunos ejemplos.
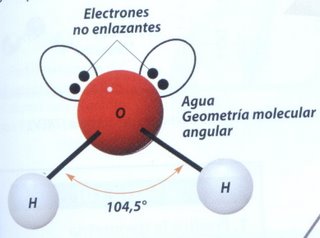
- La molécula de agua H2O posee dos enlaces simples O - H y yiene dos pares de electrones no enlazantes en el átomo de oxígeno. Su geometría molecular es angular.
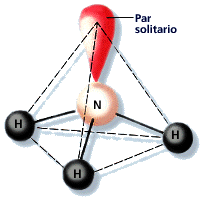
- La molécula de amoníaco (NH3) presenta 3 enlaces simples N - H y posee un par de electrones no enlazantes en el nitrógeno. La geometría molecular es piramidal.
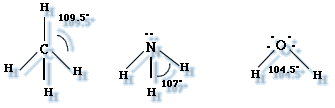
- La molécula de metano (CH4) tiene cuatro enlaces simples C - H y ningún part de electrones enlazantes. Su geometría molecular es tetraédrica.
¿Cómo se puede saber la geometría de una molécula?
En la actualidad se emplean diversos métodos experimentales para conocer en forma precisa la estructura de una molécula particular. Pero en ocasiones basta con aplicar algunos métodos sencillos para obtener una geometría molecular aproximada.
Uno de los métodos para predecir la geometría molecular aproximada, está basada en la repuslsión electrónica de la órbita atómica más externa, es decir, los pares de electrones de valencia alrededor de un átomo central se separan a la mayor distancia posible para minimizar las fuerzas de repulsión. Estas repulsiones determinan el arreglo de los orbitales, y estos, a su vez, determinan la geometría molecular, que puede ser lineal, trigonal, tetraédrica, angular y pirámide trigonal.
Geometría lineal: Dos pares de electrones alrededor de un átomo centarl, localizados en lados opuestos y separdos por un ángulo de 180º.
Geometría planar trigonal: Tres pares de electrones en torno a un átomo central, separados por un ángulo de 120º.
Geometría tetraédrica: Cuatro pares de electrones alrededor de un átomo central, ubicados con una separación máxima equivalente a un ángulo de 109,5º.
Geometría pirámide trigonal: Cuatro pares de electrones en torno a un átomo centra, uno de ellos no compartido, que se encuentran separados por un ángulo de 107º.
Geometría angular: Cuatro pares de electrones alrededor de un átomo central, con dos de ellos no compartidos, que se distancian en un ángulo de 104,5º.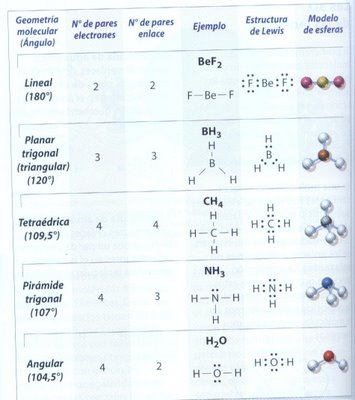

Al leer todas estas descripciones, vemos que la forma de las moléculas es el resultado de las direcciones en que se ubican los electrones enlazantes. Parece increíble pensar que la forma que tiene una molécula es determinante en la manera como actúa, estableciendo sus propiedad
No hay comentarios:
Publicar un comentario